治験臨床研究センター
| 概要 | 患者さんへ(治験とは・・・。) |
| 治験審査委員会に関する情報 | |
| 臨床研究に関する情報公開について(オプトアウト) | |
| 現在募集中の治験一覧 | |
| 治験・製造販売後試験の依頼者方へ(標準業務手順書・治験の書式と手続き等) | |
| 製造販売後調査依頼者の方へ(書式と手続き等)) | |
| 倫理審査委員会に関する情報 | |
概要
治験臨床研究センターは、新しい医薬品や医療機器の開発(治験)、医薬品や医療機器の適正使用に関する調査(製造販売後調査等)、疾病の予防・診断・治療法の改善を目的とした研究(臨床研究)に関する手続き等を統括管理し実施を支援する組織です。
当院では、平成31年に治験臨床研究センターを開設し、治験の円滑な実施のための支援体制の構築、臨床研究の支援をしています。
| 所 在 地 | 〒998-8501 山形県酒田市あきほ町30番地 |
|---|---|
| 電 話 | 0234-26-2001 |
| スタッフ | センター長 木村 守(代謝内科) 副センター長 成田 康之(薬剤師・CRC) 看護師 2名(CRC) 事務 1名 |
| その他スタッフ | 薬剤部治験担当:薬局長、薬剤師2名 |
| 検査部治験担当:検査技師1名 | |
| 看護部倫理審査担当:看護師1名 |
業務内容
- 治験支援(治験審査委員会事務局・治験事務局)
- 倫理審査委員会事務局
- 臨床研究支援(特定臨床研究・一般臨床研究・製造販売後調査等)など
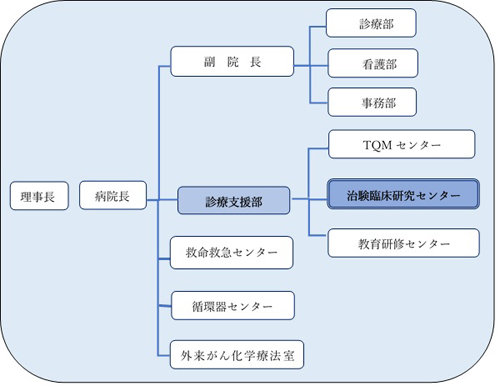
組織図(日本海総合病院の治験臨床研究センターに関わる組織図)
患者さんへ(治験とは)
化学合成や、植物、土壌中の菌、海洋生物などから発見された物質の中から、試験管の中での実験や動物実験により、病気に効果があり、人に使用しても安全と予測されるものが「くすりの候補」として選ばれます。この「くすりの候補」の開発の最終段階では、健康な人や患者さんの協力によって、人での効果と安全性を調べることが必要です。こうして得られた成績を国が審査して、病気の治療に必要で、かつ安全に使っていけると承認されたものが「くすり」となります。
人における試験を一般に「治験」といいますが、「くすりの候補」を用いて国の承認を得るための成績を集める臨床試験は、特に「治験」と呼ばれています。
皆さんは、新しい「くすり」がどのようにしてできているかご存知ですか?
新しい薬が誕生するまで
基礎研究

研究者たちが、植物や、化学物質、微生物などの中からくすりになりそうな物質を探します。この中からくすりとなる物質を見つけます。
非臨床試験

まず動物(ネズミ、ウサギ、イヌなど)で安全かどうか、効き目はあるのかどうかを調べます。
臨床試験(治験)
- 第1段階(第Ⅰ相)
- 少人数の健康な成人を対象に、安全かどうか調べます。また、くすりがどのくらいの時間で体の中に吸収されるか、そして排泄されるか調べます。
- 第2段階(第Ⅱ相)
- 少人数の患者さんを対象に、どれだけくすりの効果があるか(有効性)とどんな種類の副作用がどのくらい現れるか(安全性)、くすりの使い方(量・使う期間・使う間隔など)を調べます。
- 第3段階(第Ⅲ相)
- 安全性の確認が進み、多人数の患者さんを対象に、有効性、安全性、くすりの使い方の最終的な確認を行います。
承認審査

これまで行ってきた基礎研究から治験のデータ(皆さまが参加されたときの貴重なデータ)などをもとに厚生労働省(国)がくすりとして認めるかどうかが審査されます。
新薬誕生
審査をパスして初めて市場(薬局、病院)に出るのです。

|

|
第4段階(第Ⅳ相)製造後販売調査

厚生労働省(国)がくすりとして認めた後にも、条件等によってはもう一度安全性や効き目をチェックします 。
治験に参加したい方は

当院で実施される治験に参加したい方は、募集中の治験からお問い合わせをください。また、診察時に医師より治験を勧められることもあります。医師より治験を勧められた患者さんには、医師より治験の説明を受けたあと、コーディネーターより補足説明をさせていただきます。
治験への参加は、患者さん本人の自由意思に委ねられます。納得のいくまで説明をお受けください。十分な時間をかけて、内容をご理解いただいてから治験の参加の可否をお決めください。家族の方にも相談し、理解してもらうことも治療をする上で重要です。
治験に参加することになると、
- *決められた来院スケジュールに沿って診察・検査を受けていただきます。
- *参加期間中は、使用できる治療・薬に制限や使用不可のものがあります。
- *健康状態や診察の効果を診るために日誌や記録をつけていただく場合もあります。
- *通常の診察に比べて検査や来院回数が増える場合があります。
また、治験に参加していただいた後でも、いつでも参加を取りやめることができます。
治験に参加しなくても、参加を取りやめても診療に差し支えるなどの不利益は一切ありません。
費用について
「くすりの候補」を使用している期間は、一部の薬代や画像診断等の検査の費用は依頼者(製薬会社)が負担します。(治験の種類や内容により、費用の負担は異なります。)詳しくは治験の同意をいただく際に説明いたします。
臨床研究・治験相談窓口
治験・臨床研究に関する相談窓口を設置しています。疑問や不安のある方はお気軽に治験臨床研究センターにご相談ください。
|
担当:治験臨床研究センター 治験事務局
Tel:0234-26-2001 |
 |
治験審査委員会に関する情報
治験は、患者さんや健康人の方々を対象としておこなう試験ですので、人格を尊重し、安全に、正義をもって実施されなければなりません。計画している治験が、これらの要件を満たしているかどうか、治験を実施しても問題ないかどうか、治験を始める前に第三者の意見を聞く必要があります。この第三者機関のことを治験審査委員会といいます。当院では、治験を始める前には必ず治験審査委員会の審査を受けることが決まりとなっています。
◆治験審査委員会における治験審査基準(別紙) PDF
◆令和7年度 治験審査委員会名簿 PDFNEW!
◆令和7年度 治験審査委員会開催日 PDFNEW!
◆治験審査委員会議事録(PDF) |
 |
臨床研究に関する情報公開について(オプトアウト)
通常、臨床研究を実施する際には、文書もしくは口頭で説明・同意を行い実施します。臨床研究のうち、患者さんへの侵襲や介入もなく診療情報等の情報のみを用いた研究や、余った検体のみを用いるような研究については、国が定めた指針に基づき対象患者さんから直接同意を取得する代わりに、研究の目的を含めて情報を公開し、更に拒否の機会を保障する方法があります。このような手法を「オプトアウト」と言います。オプトアウトを用いた臨床研究は下記のとおりです。

なお、研究への協力を希望されない場合や、臨床研究に関して知りたいことがある方は、下記担当にお知らせください。 研究不参加を申出られた場合でも、以後の診療において何ら不利益を受けることはありません。
地方独立行政法人山形県酒田市病院機構 日本海総合病院
治験臨床研究センター(倫理審査委員会事務局)
〒998-8501 山形県酒田市あきほ町30番地
電話番号 : 0234-26-2001
FAX番号 : 0234-31-7230
実施臨床研究一覧
平成26年度実施臨床研究一覧 PDF 平成27年度実施臨床研究一覧 PDF 平成28年度実施臨床研究一覧 PDF 平成29年度実施臨床研究一覧 PDF 平成30年度実施臨床研究一覧 PDF 西暦2019年度実施臨床研究一覧 PDF 令和 2年度実施臨床研究一覧 PDF 令和 3年度実施臨床研究一覧 PDF 令和 4年度実施臨床研究一覧 PDF
現在募集中の治験臨床研究
腎デナベーションを用いた高血圧症患者を対象とした臨床試験 PDF 旭化成ファーマ株式会社の依頼によるAK1910の第Ⅰ相試験 PDF 中外製薬株式会社の依頼による全身性エリテマトーデス患者を対象としたRO5072759の第III相試験 PDF
|
担当:治験臨床研究センター
治験事務局 Tel:0234-26-2001 |
 |
治験・製造販売後試験の依頼者の方へ
日本海総合病院における治験に関わる標準業務手順書(SOP)
◆治験に係る標準業務手順書 PDF ◆治験審査委員会 標準業務手順書 PDF 直接閲覧を伴うモニタリング・監査の受け入れに関する標準業務手順書 PDF ◆治験審査委員会審査資料の電子化に関する手順書 PDF
書式
・治験・製造販売後臨床試験の書式は、各社作成して下さい。
治験の問い合わせについて
日本海総合病院にて医薬品等製造販売後調査を依頼する場合は手続きが必要となります。
詳しくは治験臨床研究センターまでご連絡ください。
|
【問い合わせ】
受付日時 : 平日9:00~16:00 TEL : 0234-26-2001 ※ あらかじめ電話でのご連絡をお願い致します。 |
手続きについて
医薬品等製造販売後調査の依頼者の方へ
取扱要綱
医薬品等製造販売後調査の書式一覧
1.医薬品等製造販売後調査依頼書(様式1) Word 2.医薬品等製造販売後調査審査依頼書(様式2) Word 3.医薬品等製造販売後調査委託契約書(様式4) Word 4.覚書(様式5) Word 5.医薬品等製造販売後調査 一部終了報告書(様式7) Word 6.医薬品等製造販売後調査 終了報告書(様式8) Word
医薬品等副作用等調査の書式一覧
1.医薬品等副作用等調査依頼書(様式1) Word 2.医薬品等副作用等調査委託契約書(様式4) Word 3.覚書(様式5) Word 4.医薬品等副作用等調査終了報告書(様式8) Word
問い合わせについて
日本海総合病院にて医薬品等製造販売後調査を依頼する場合は手続きが必要となります。詳しくは治験臨床研究センターまでご連絡ください。
|
【問い合わせ】
受付日時 : 平日9:00~16:00 TEL : 0234-26-2001 ※ あらかじめ電話でのご連絡をお願い致します。 |
手続きについて
倫理審査委員会に関する情報
- ・倫理審査委員会は、基本的に奇数月の第4月曜日に開催しております。
- ・書類の提出〆切は前月の第4月曜日です。
(但し、件数が多い場合、次回受付とさせていただく場合があります。) - ・書類を作成する場合は、国が定める「人を対象とする生命科学・医学系研究に関する倫理指針」を参照してから作成してください。
- ・委員会当日は研究責任者または分担研究者に委員会で説明を行っていただきます。
- ・倫理委員会からの問い合わせや審査結果の通知はすべて研究責任者に行います。
◆倫理審査に必要な様式
倫理委員会名簿及び開催日
◆結果報告書(PDF)
◆日本海総合病院では、輸血治療が必要となる可能性がある患者が宗教的信念により輸血を拒み、無輸血治療を要請する患者さんに対して、以下の資料に基づき治療をおこないます。
研究に関する指針について
- 医学研究に関する指針一覧
- 厚生労働省においては、これまで関係省庁等とも連携し、適正に医学研究を実施するための指針の策定を進めてきました。また、平成17年度からは、新たに施行された「個人情報の保護に関する法律」(平成15年法律第57号)の趣旨を踏まえ、指針等の見直しを実施するとともに、指針等の遵守を厚生労働科学研究費補助金等の交付の条件とし、違反があった場合には補助金の返還、補助金の交付対象外(最大5年間)とする措置を講ずることがあり得るものとしております。
なお、国立の研究機関や独立行政法人、国立大学法人などにおける個人情報の保護に関しては、本ページで紹介している指針等以外に、それぞれ「行政機関の保有する個人情報の保護に関する法律」(平成15年法律第58号)や「独立行政法人等の保有する個人情報の保護に関する法律」(平成15年法律第59号)の適用を受けることとなりますので、ご留意ください(行政機関・独立行政法人等の個人情報の保護のページ(総務省))。
今後とも、指針等を遵守し、適正な研究の実施に努めて頂きますようお願いいたします。
(以下に、交付の条件とされている指針等の一部やその他参考となる指針などを掲載しておりますので、ご参照ください。)「厚生労働省ホームページ」(https://www.mhlw.go.jp/)
- 1 人を対象とする生命科学・医学系研究に関する倫理指針
- 2 遺伝子治療等臨床研究に関する指針
- 3 手術等で摘出されたヒト組織を用いた研究開発の在り方
- 4 厚生労働省の所管する実施機関における動物実験等の実施に関する基本指針
- 5 異種移植の実施に伴う公衆衛生上の感染症問題に関する指針
- 6 ヒト受精胚の作成を行う生殖補助医療研究に関する倫理指針
- 7 ヒト受精胚に遺伝情報改変技術等を用いる研究に関する倫理指針
- 8 廃止となった指針
1 人を対象とする生命科学・医学系研究に関する倫理指針
- 人を対象とする生命科学・医学系研究に関する倫理指針(本文)(令和3年3月23日)
- 人を対象とする生命科学・医学系研究に関する倫理指針ガイダンス(令和3年4月16日)
- 様式集
- 施行通知(令和3年3月23日)
- 事務連絡(令和3年4月16日)
- 「人を対象とする生命科学・医学系研究に関する倫理指針」説明資料
- 参考:臨床研究法について
「厚生労働省ホームページ」(https://www.mhlw.go.jp/)